Школьная олимпиада по химии для 9-х классов
Состоит из двух туров (заочный и очный) с вопросами различного уровня сложности и ответами.
I тур школьной олимпиады по химии
(заочный этап)
9.1. (5 б.) Воздух объемом 10 л содержит ксенон объемом 6·10-5 мл. В каком объеме воздуха (н.у.) содержится 1012 молекул ксенона?
9.2. (5 б.) На весах 0,3 моль оксида меди (II). Какое количество вещества оксида магния нужно положить на другую чашку весов, чтобы они уравновесились?
9.3. (5 б.) Какую массу поташа нужно внести в почву, чтобы в нем содержалось столько же питательного элемента калия, сколько его в 5,96 кг хлорида калия.
9.4. (4 б.) Какова должна быть концентрация 1 кг раствора гидроксида натрия, чтобы полностью нейтрализовать 1,25 моль фосфорной кислоты.
9.5. (4 б.) Имея только воду и соляную кислоту разделите смесь веществ: хлорида кальция, карбоната кальция и хлорида серебра.
9.6. (3 б.) Сколько молекул в 1 мл воды?
9.7. (3 б.) Чему равна масса (г) одной молекулы серной кислоты?
9.8. (3 б.) Куда вы направите газоотводную трубку: а) вниз; б) вверх при собирании следующих газов: угарный газ, углекислый газ, фтор, неон, аммиак.
9.9. (3 б.) Определите степень окисления всех элементов в следующих соединениях: K2Cr2O7, Fe3(PO4)2, Fe(OH)SO4, Bi2(SO4)3, Na2B4O7, NaClO, Ca(ClO)2, (NH4)2CO3.
9.10. (2 б.) Какая из связей более полярна:
H – S, H – P, H – Cl, H – Br, H – J.
9.11. (2 б.) Назовите соли: Cu(NO3)2, KHCO3, Cu2(OH)2CO3, Sn(OH)Cl, Ba(HS)2, Mg(HCO3)2, NH4NO3.
9.12. (1 б.) Напишите уравнения реакций получения сульфата меди (II) всеми возможными способами.
9.13. Используя метод электронного баланса, составьте уравнения реакций, протекающих по схемам:
(3 б.) а) KNO2+KJ+H2SO4→J2+NO+K2SO4+H2O
(5 б.) б) FeCl2+KMnO4+HCl→FeCl3+Cl2+MnCl2+KCl+H2O
9.14. (3 б.) Как окрасится лакмус после сливания раствора, содержащего 0,1 моль гидроксида калия и раствора, содержащего 0,05 моль серной кислоты?
9.15. (3 б.) Что происходит с радиусом атома кальция при превращении его в ион? Ответ подтвердите схемами строения частиц.
9.16. (3 б.) Какие из частиц имеют такую же схему строения, как и ион кальция: ион хлора, атом неона, ион натрия, атом аргона? Изобразите схемы строения всех частиц.
9.17. (2 б.) Какое вещество будет восстанавливать Pb2+ до Pb0, но не будет восстанавливать Mg2+ до Mg0: медь, натрий, серебро или цинк?
9.18. (2 б.) Какие из частиц могут быть:
а) восстановителем; б) окислителем; в) окислителем и восстановителем; г) инертной
Cl-, S+6, Ar, S2-, N+5, Ne, H+, N+3, So.
9.19. (2 б.) Какой из элементов является самым сильным окислителем: Na, Al, S, Cl, P, K?
9.20. (5 б.) Определите массовую долю безводного сульфата меди (II) в растворе, приготовленном растворением кристаллогидрата CuSO4·5H2O массой 50г в порции воды массой 150 г.
9.21. (4 б.) Осуществите превращения с помощью химических реакций:
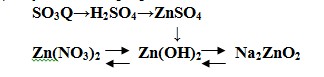
9.22. (10 б.) Железо, массой 12,2 г сплавили с серой массой 6,4 г. К полученному продукту добавили избыток соляной кислоты. Выделяющийся газ пропустили через раствор массой 200 г с массовой долей хлорида меди (II) 15%. Какая масса осадка образовалась?
9.23. (10 б.) Необходимо приготовить сплав олова со свинцом, в котором массовая доля свинца равна 46,5%. Какую массу оксида олова (IV) и оксида свинца (II) надо взять, чтобы при восстановлении их углем получился требуемый сплав массой 44,5 г?
Ответы к 1 туру олимпиады:
10.1. 6,2 •10-6 м3
10.2. 0,6 моль
10.3. 5,52 кг
10.4. 15 %
9.6. 3,3 • 1022 молекул
9.7. 1,63 • 10-25 кг (10-27 г)
9.8. а) CO2, F2 б) CO, Ne, NH3
9.10. H-Cl
9.13. a) 2KNO2+2KJ+2H2SO4→J2+2NO+2K2SO4+2H2O
б) 8FeCl2+2KmnO4+16HCl→8FeCl3+Cl2+2MnCl2+2KCl+8H2O
9.14. фиолетовый
9.15. уменьшится
9.16. Cl-, Ar
9.17. Zn
9.18. а) Cl-, S2-; б) S+6, N+5, H+; в) S0, N+3; г) Ar, Ne
9.19. Cl
9.20. 16 %
9.22. 19,2 г.
9.23. 30,2 г SnO2; 22,3 г PbO
Школьная олимпиада по химии для 9-х классов II тур
(очный этап выполняется в школе)
1. Разделить смесь веществ: оксид меди (II), хлорид калия, оксид кремния, йод. (5 б.)
2. Подожгли смесь 10 г водорода и 10 л кислорода (н. у.). Сколько воды образовалось? Сколько и какого газа осталось? (4 б.)
3. Напишите с помощью химических реакций все возможные способы получения сульфата железа (II). (по 1 б.)
4. Используя метод электронного баланса, составьте уравнение реакции, протекающей по схеме: (3 б.)
Na2SO3+KMnO4+KOH→Na2SO4+K2MnO4+H2O
5. Какие из частиц имеют такую же схему строения как и ион алюминия: ион магния, ион фтора, атом неона, атом натрия? Изобразите схемы строения всех частиц. (3 б.)
6. Осуществите превращения с помощью химических реакций по схеме: (4 б.)
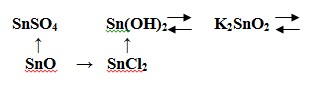
7. Какой минимальный объем раствора с массовой долей хлороводорода 20 % и плотностью 1,1 г/мл потребуется для растворения смеси цинка и никеля массой 49 г, если массовая доля никеля в смеси 60,2 %? (5 б.)
Ответы ко второму туру олимпиады:
1. 16,2 г воды, 3,2 г кислорода
4. Na2SO3+2KMnO4+2KOH→Na2SO4+2K2MnO4+H2O
7. 265,5 мл.
Если материал полезен для Вас, пожалуйста, поделитесь с друзьями в соцсетях!
| < Предыдущая |
|---|

